Созревание Оствальда
Созревание Оствальда - это процесс растворения и повторного осаждения частиц. В 1896 году ученый Вильгельм Оствальд описал этот процесс, именно поэтому он был назван в его честь.
Основной причиной этого процесса является то, что большие частицы термодинамически более предпочтительны, чем мелкие частицы и по этой же причине этот процесс является спонтанным. Он может происходить в эмульсионных системах, где молекулы переходят от маленьких к большим каплям. Например, эти факты можно наблюдать при исследовании на DFA100.
Механизм
Созревание Оствальда вызвано термодинамикой и происходит потому что большие частицы являются более энергетически выгодными, нежели частицы с наименьшим размером.
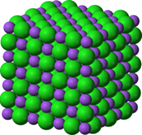
В кубическом кристалле атомов все атомы связаны с 6 соседями (являются стабильными), а атомы на поверхности связываются с пятью соседями или меньше, именно поэтому эти атомы менее стабильны.
Рисунок 1 - Кубическая кристаллическая структура хлорида натрия
Частицы с 6 соседями являются более энергетически выгодными, потому что c ними связано больше атомов, в сравнении с теми, что находятся на поверхности. Молекулы, которые находятся на поверхности маленькой частицы, будут стремиться оторваться от частицы в тот момент, когда система будет пытаться снизить свою общую энергию, в соответствии с уравнением Кельвина. В этот момент происходит увеличение концентрации свободных молекул в растворе. В момент перенасыщения свободные молекулы конденсируются на поверхности более крупных частиц. Отсюда можно сделать вывод, что мелкие частицы сжимаются, а крупные- растут., соответственно средний размер увеличивается. В момент, когда время начинает стремиться к бесконечности, все частицы собираются в сферу, чтобы общая площадь поверхности стала меньше.
В 1958 году Лифшиц и Слёзов проводили математическое исследование созревания Оствальда в период, когда диффузия материала является достаточно медленным процессом. Уравнение описывает границу между уменьшающимися и растущими частицами. Был сделан вывод, что следующий радиус частиц возрастает:
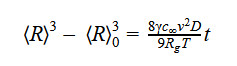
〈R〉 - средний радиус всех частиц
γ - поверхностное натяжение частицы или поверхностная энергия
c∞ - знак равно растворимость материала частиц
ν - молярный объем материала частицы
D - коэффициент диффузии материала частицы
Rg - постоянная идеального газа
T - абсолютная температура
t - время
Также Лифшиц и Слёзов пришли к уравнению для функции распределения частиц по размерам f (R,t). Образуется новая переменная ρ=R(〈R〉)-1, так как для удобства радиус частиц делится на средний радиус.
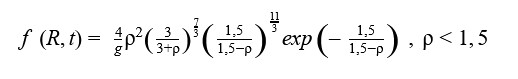
В 1961 году Карл Вагнер исследовал две системы, в которых диффузия и отрыв частиц на поверхности были медленными. Несмотря на то, что расчеты отличались, Вагнер пришел к таким же выводам, что Лифшиц и Слёзов. Одинаковые выводы оставались незамеченными долгое время ровно до тех пор, пока в 1975 году Кальвейт объединил их в теории Лифшица-Слёзова-Вагнера или теория созревания Оствальда.
Вагнер сделал вывод, что в момент отрыва молекул и их присоединения скорость роста становится равной:
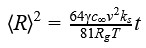
где ks-константа скорости реакции
С помощью измерения среднего радиуса можно определить, будет ли подчинена система уравнению медленной диффузии или уравнению медленного прилипания. Если данные не подчиняются ни одному уравнению, то можно прийти к выводу, что созревание Оствальда не подходит.
Созревание Оствальда рассматривались только в созревании твердых веществ в жидкости, но, как было доказано, оно также наблюдается в системе жидкость-жидкость, например, в эмульсионной полимеризации. Происходит диффузия из мелких капель в крупные капли (в связи с большей растворимостью). Скорость процесса напрямую связана с растворимостью мономера в эмульсии. Это может привести к дестабилизации эмульсии (например, из-за вспенивания).
Примеры
Рассмотрим перекристаллизацию воды в мороженом. Более крупные кристаллы льда растут за счет более мелких (которые находятся внутри мороженого).
Эффект узо: капли микроэмульсии возрастают в результате созревания Оствальда. Обычным примером созревания по Оствальду является перекристаллизация воды в мороженом, которая придает старому мороженому зернистую хрустящую текстуру. Более крупные кристаллы льда растут за счет более мелких кристаллов внутри мороженого, создавая более грубую текстуру. Другой гастрономический пример - эффект узо, когда капельки мутной микроэмульсии растут в результате созревания Оствальда.
Созревание может также происходить в эмульсионных системах. Когда нужна миниэмульсия, добавляется гидрофобное соединение для остановки процесса.
Есть вопросы
или нужно подобрать
оборудование?